一、不对称催化(不对称氢化,烯丙醇的异构化)
1、不对称氢化
氢气是最简单的双原子分子,也是一种清洁、廉价的化学原料。手性过渡金属络合物催化的氢气对不饱和化合物(含有C=C、 C=O以及C=N不饱和键的化合物)的不对称还原是构建手性化合物最为有效的合成方法之一,该方法因具有高原子经济性,高效高选择性及环境友好等优点,受到工业界和学术界广大科研工作者的青睐。1968年Knowles和Horner分别报道了手性膦铑络合物对烯烃的不对称氢化,经过四十多年的发展, 不对称催化氢化已成功应用于合成包括手性氨基酸、手性醇、手性胺等多种化合物,并且在医药、农药、食品添加剂等工业生产方面也取得了广泛应用. 2001年诺贝尔化学奖授予在该研究领域中作出杰出贡献的科学家William S. Knowles 和 Ryoji Noyori就是对不对称催化氢化反应为人类社会进步做出的卓越贡献的褒奖和肯定。
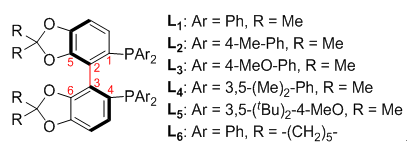
不对称催化氢化反应的选择性和效率取决于手性配体及手性催化剂. 因此, 发展新型、高效的手性配体及其催化剂一直是不对称催化氢化反应研究的关键和核心。我们课题组设计合成了C2-不对称轴手性双膦配体SunPhos, 并利用其实现了一系列羰基酮化合物的高效高选择性不对称氢化。 尤其是考虑到对官能化酮的不对称氢化在重要天然产物、药物中间体合成中的重大应用,研究并实现了对包括更具挑战性的多官能化酮的不对称氢化并取得了鼓舞人心的成果,主要底物类型包括:α-羰基weinreb酰胺,β-羰基砜,α-氨基-β-羰基磷酸酯;4-芳基-2-氧代-3-丁烯酸乙酯,γ-杂原子-β-羰基羧酸酯;γ-卤代-γ,δ-不饱和-β-酮酸酯,3-氧代戊二酸衍生物,3, 5-二氧代羧酸衍生物等。通过对官能化酮不对称氢化的系统性研究,我们在多官能化羰基酮的不对称氢化方面取得了一些重要进展,对于各种杂原子和羧酸衍生物羰基在不对称氢化反应中的配位导向能力也有了较为深刻的认识。今后我们希望通过对多官能化羰基酮不对称氢化反应的机理性研究来获得更为深刻的了解,以求更好的解决在不对称氢化反应中经常要同时面对的化学选择性,对映选择性以及非对映选择性的难题。
2、烯丙醇的异构化
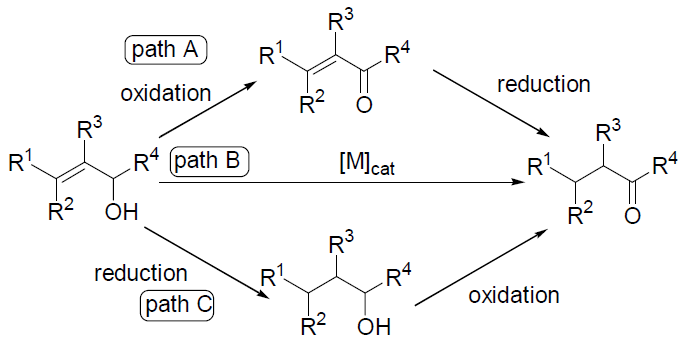
羰基化合物(如酮、醛)是重要的精细化学品、有机合成中间体. 烯丙醇化合物作为一类重要的化工原料,在羰基化合物的合成中具有广泛的应用, 传统上通过烯丙醇来合成羰基化合物有两种路径: (1)将烯丙醇氧化成α,β-不饱和羰基化合物, 然后再还原双键(Path A). (2)先将双键还原, 再对醇进行氧化(Path C). 但这两种途径都需要经历繁琐的氧化和还原步骤, 尤其Path A 中不饱和羰基化合物的还原要求催化剂能够选择性地催化还原C=C 双键, 这极大地给生产应用带来不便. 而利用过渡金属催化烯丙醇异构化反应直接合成相应的羰基化合物(Path B), 不仅避免了复杂的氧化和还原步骤,而且具有高效、绿色、原子经济好的优点, 满足现代社会提出的绿色化学理念, 此类反应受到人们越来越多的关注。
二、可见光催化
我们课题组从2013年与华中师范大学肖文精课题组联合申请了可见光催化反应的重点项目。我们致力于发展一系列温和,高效的可将光催化反应用于合成一系列有机小分子。目前工作主要围绕C-X键的活化,N杂环化合物的构建等,一系列相关工作正在开展中。
三、硅氢还原
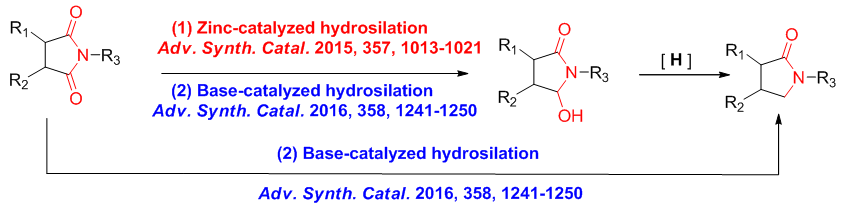
有机硅氢化合物是硅化工的工业中间体,因此易得、价格比较廉价。大多数的硅氢化合物比较稳定,可以在空气环境下储存,易于操作。硅氢化反应是指硅氢键加成到碳碳不饱和键及碳杂不饱和键是合成有机硅类化合物重要的反应之一,被广泛的应用得有机合成、聚合物化学以及材料科学中。高选择性的硅氢化反应在有机合成中的对不饱和键的还原中常常显示出独特的选择性,被广泛应用到高化学选择性、区域选择性及立体选择性的羰基还原反应中。我们致力于研究不同类别催化剂(过渡金属催化剂、路易斯酸类催化剂以及路易斯碱类催化剂)及硅氢试剂的结构对酰亚胺类化合物、羧酸及其衍生物等的影响,高选择性的还原这类化合物并将其应用到药物分子及天然产物的合成中。
并且我们组通过采用温和的硅氢还原的方法、利用不同的催化体系高效高选择性的合成了ω-羟基内酰胺以及异吲哚啉酮类化合物,这些工作分别于2015年以及2016年发表在Advanced Synthesis & Catalysis这一期刊上。
四、其他过渡金属催化
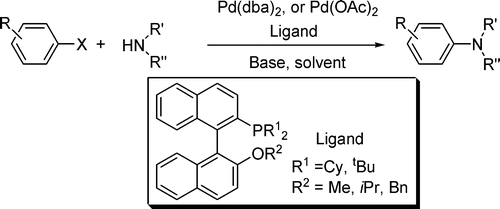
我们课题组发展了以联萘为骨架的单膦配体,可以通过其不同的取代基来调节配体的电性、二面角,例如:R = Cy的大位阻富电电荷的配体时,可以实现芳基氯代烃的C-N、C-P、C-O等偶联反应。同时该类配体也可以实现一些芳基化合物的C-O的断裂反应,并进一步实现一系列的串联反应等。